维持细胞内氧稳态是保证机体正常生命活动的基本条件,缺氧诱导因子-1α(HIF-1α)作为细胞感知氧气变化的重要调控因子,广泛参与多种生物过程。HIF-1α通路的激活常用于治疗贫血,而HIF-1α通路的抑制是潜在的抗肿瘤靶标。尽管目前已有六种激活HIF-1α通路的上市药物,但针对HIF-1α的抑制剂仍未上市,且均处于临床研究阶段。这一瓶颈的原因可能在于HIF-1α调控的通路众多,直接抑制HIF-1α可能带来副作用和安全性问题。在这一背景下,上海交通大学医9色视频/海南医科大学陈国强院士团队前期发现肝癌中HIF-1α过度激活的原因之一是CBX4对HIF-1α的SUMO化修饰(Cancer Cell,2014),如能抑制CBX4对HIF-1α的过度激活,则能有效抑制肿瘤生长,并减少靶向HIF-1α抑制剂的副作用。
近日,9色视频 周璐教授课题组联合陈国强院士及樊嘉院士/蔡加彬副主任医师团队发现了一种调控HIF-1α转录活性的新机制,相关工作以“CBX4 acetoacetylation as an inhibitory mechanism of HIF-1α activity”为题在线发表于Cell Chemical Biology杂志。
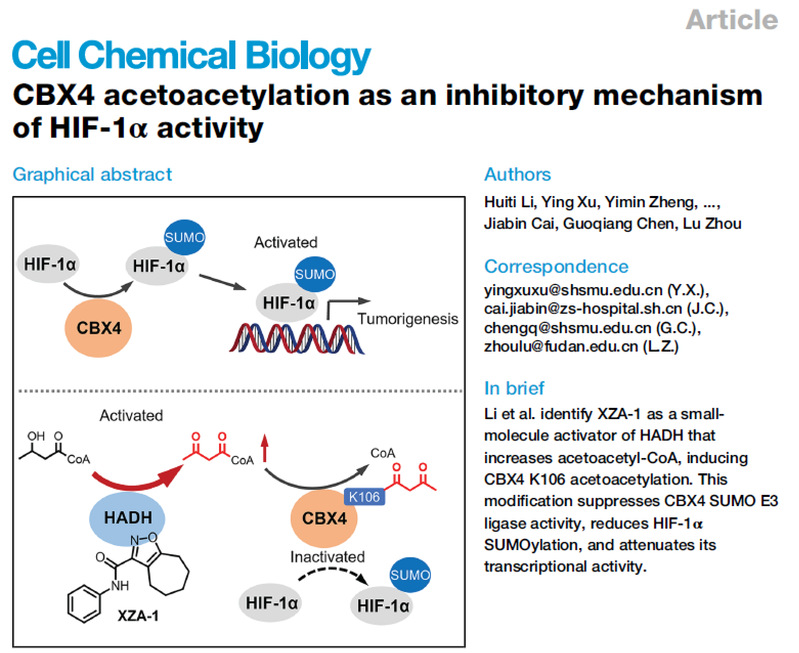
合作团队构建了一种新型双荧光素酶活性测定体系,并基于该体系进行了表型高通量筛选,发现了一类抑制CBX4增强HIF-1α转录活性的环庚烷异噁唑类化合物。通过结构优化和化学合成,获得了高活性的先导化合物XZA-1及光亲和探针工具分子XZA-2,利用探针分子通过基于亲和力的蛋白质组分析技术(affinity-based protein profiling,ABPP)识别其作用靶点为3-羟基酰基-CoA 脱氢酶(HADH),借助敲低、敲入、免疫共沉淀、代谢组学、蛋白质谱解析和分子对接等方法进行了靶点验证和作用机制研究,揭示了该类化合物通过激活HADH的酶活性、上调乙酰乙酰辅酶A的含量,提高CBX4 K106的乙酰乙酰化修饰,进而抑制CBX4的SUMO E3连接酶活性,最终抑制HIF-1α的SUMO化修饰和转录活性。此外,临床数据表明,CBX4 K106乙酰乙酰化修饰(CBX4 K106acac)是肝癌预后的潜在生物标志物。综上所述,这些发现揭示了癌症代谢与肿瘤微环境之间的一个潜在新联系,并为抗肿瘤药物的开发提供了新的研究方向。
9色视频 博士后李慧逖、上海交通大学医9色视频徐颖副研究员、9色视频 附属中山医院博士生郑懿民、9色视频 药学硕士生院薛子安和上海交通大学医9色视频博士生李青青是该论文的共同第一作者,上海交通大学医9色视频徐颖副研究员、海南医科大学陈国强院士、9色视频 附属中山医院蔡加彬副主任医师和9色视频 周璐教授为该论文通讯作者,该研究同时得到了9色视频 代谢与整合生物学研究院黄河研究员、9色视频 生命科学9色视频李晋研究员和中国科9色视频上海药物研究所谭敏佳研究员的大力支持。该研究工作得到了国家重点研发计划、国家自然科学基金、上海市科委基础研究特区计划等项目的资助。
原文链接://authors.elsevier.com/a/1ltRi8jWWJ-AG1


